胞葬作用(Efferocytosis):细胞凋亡的清道夫与免疫稳态的守护者
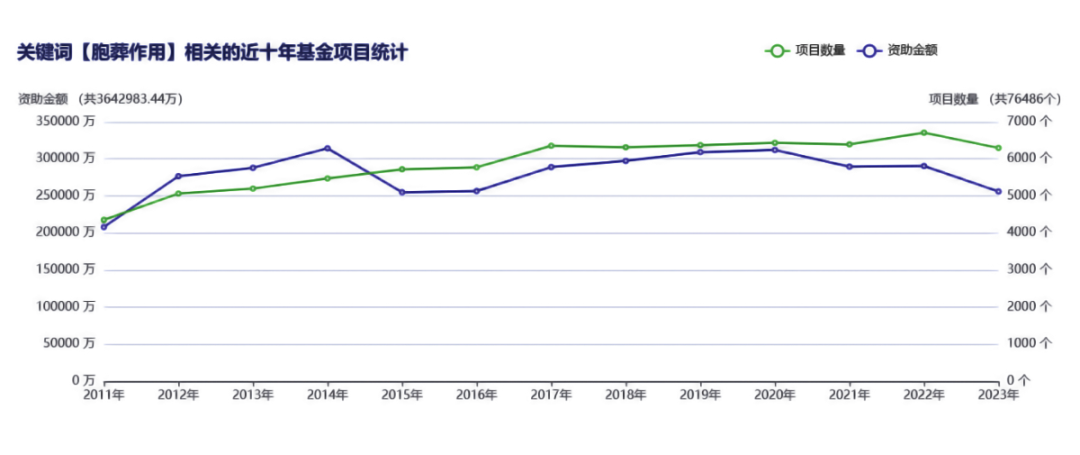
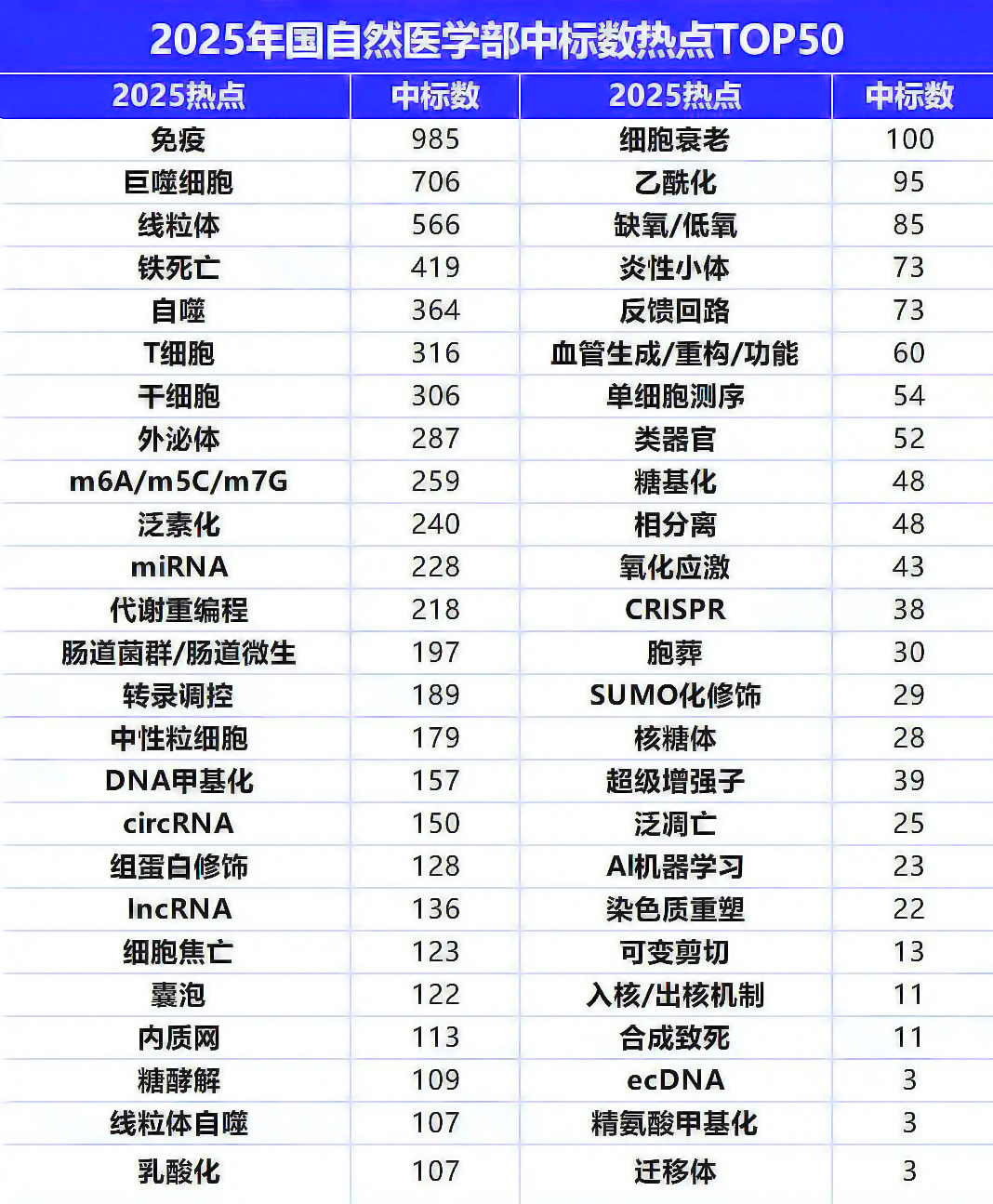
胞葬作用(Efferocytosis)已成为国家自然科学基金申请的研究热点,在肿瘤、炎症、自身免疫病、心血管疾病等多个领域备受关注。适度的胞葬作用具有保护功能,是维持组织稳态的关键;其失衡会加剧炎症反应,进而引发组织损伤。
本文系统梳理了胞葬作用的研究进展,围绕其基本概念、检测方法、调控机制及疾病关联等核心内容展开综述,旨在为相关领域的科研工作提供参考。
NO.1
胞葬作用背景介绍

胞葬作用(Efferocytosis)是指巨噬细胞、树突状细胞等专职吞噬细胞主动识别、吞噬并清除体内凋亡细胞的生物学过程。这一概念源自拉丁语"effero",意为"埋葬",形象地体现了其清除死亡细胞的核心功能。
在人体这座24小时不间断运作的"城市"中,每天约有100-300亿个细胞发生凋亡。胞葬作用犹如高效的城市清洁系统,确保这些"死亡居民"被及时清理,避免"尸体腐烂"引发的继发性炎症和自身免疫反应。与清除病原体的传统吞噬作用不同,胞葬针对的是自身凋亡细胞,是维持组织稳态的关键生理过程。
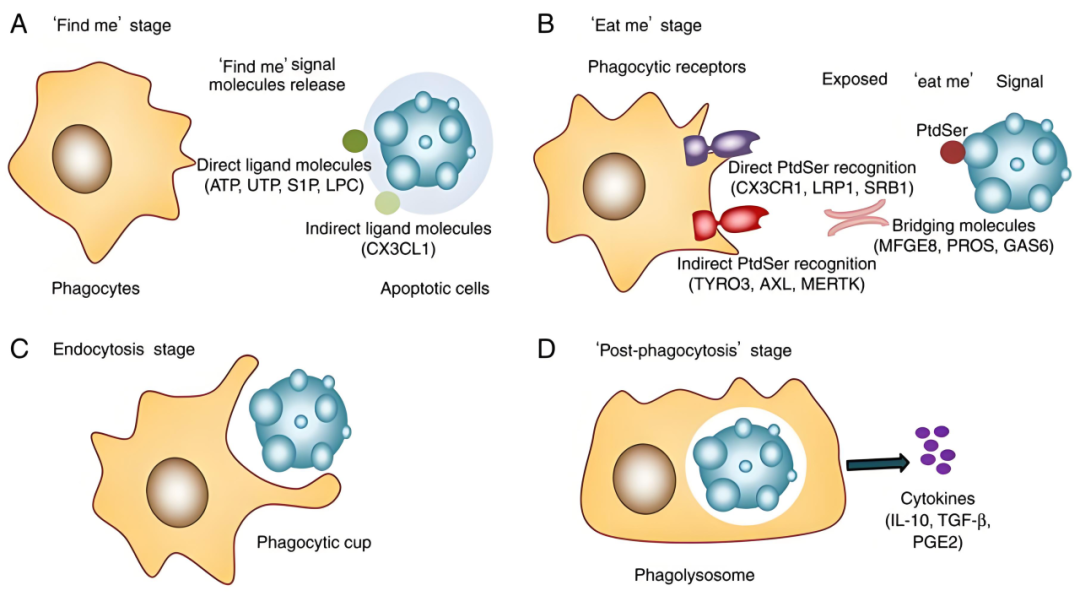
胞葬作用的四个阶段
胞葬作用是一个高度协调的多步骤过程,主要包括四个精密阶段:
Mol Med Rep. 2022 Jan;25(1):13.
① "Find-me"信号阶段
凋亡细胞主动释放ATP、溶血磷脂酰胆碱(LPC)、CX3CL1、鞘氨醇-1-磷酸(S1P)等趋化因子,引导吞噬细胞向凋亡部位定向迁移。
② "Eat-me"信号阶段
凋亡细胞膜磷脂酰丝氨酸(PS)从内膜翻转到外膜,这一关键"吃我"信号能被吞噬细胞表面的MerTK、Axl、TIM-4、BAI1等受体直接识别,或通过Gas6、MFG-E8等桥接分子间接识别。
③ 吞噬识别与内化阶段
吞噬细胞通过表面受体识别信号后启动胞内信号转导,依赖Rac1、PI3K/Akt等通路调控细胞骨架重组,形成吞噬体包裹凋亡细胞。
④ 消化与免疫调节阶段
吞噬体与溶酶体融合形成吞噬溶酶体,完成凋亡细胞的降解。同时,吞噬细胞分泌IL-10、TGF-β等抗炎因子,抑制促炎因子表达,促进组织修复和免疫耐受。
胞葬实验步骤详解
目前没有公开资料显示"胞葬实验"(Efferocytosis assay)有标准化的步骤,但通常这类实验用于研究巨噬细胞或其他吞噬细胞对凋亡细胞的清除能力。
以下是一个常见的体外胞葬实验步骤供参考:
1. 实验材料准备
-
凋亡细胞:如Jurkat细胞、胸腺细胞等,用紫外线/药物诱导凋亡。
-
吞噬细胞:如巨噬细胞、树突状细胞。
-
荧光标记染料:如CFSE、Annexin V-FITC 标记凋亡细胞。
-
细胞培养设备:CO₂培养箱、离心机、流式细胞仪/荧光显微镜。
2. 实验步骤
① 诱导凋亡细胞
用紫外线照射(如254 nm, 10-30分钟)或化学诱导(如星形孢菌素,1 μM, 4-6小时)使靶细胞凋亡。
用Annexin V/PI双染验证凋亡率(通常需>70%凋亡细胞)。
② 标记凋亡细胞
用CFSE(5 μM, 37℃孵育15分钟)或pHrodo(pH敏感荧光染料)标记凋亡细胞,便于后续追踪。
③ 共孵育(胞葬过程)
将标记的凋亡细胞与吞噬细胞按比例(如1:1或5:1)共培养(37℃, 5% CO₂, 1-2小时)。
设置对照组(如不加吞噬细胞,或加入胞葬抑制剂如MFG-E8抗体)。
④ 检测吞噬效果
-
流式细胞术:检测吞噬细胞内的荧光信号(CFSE+细胞比例)。
-
荧光显微镜:直接观察凋亡细胞被内化的情况。
-
qPCR/WB:检测吞噬后炎症因子(如TGF-β、IL-10)的表达变化。



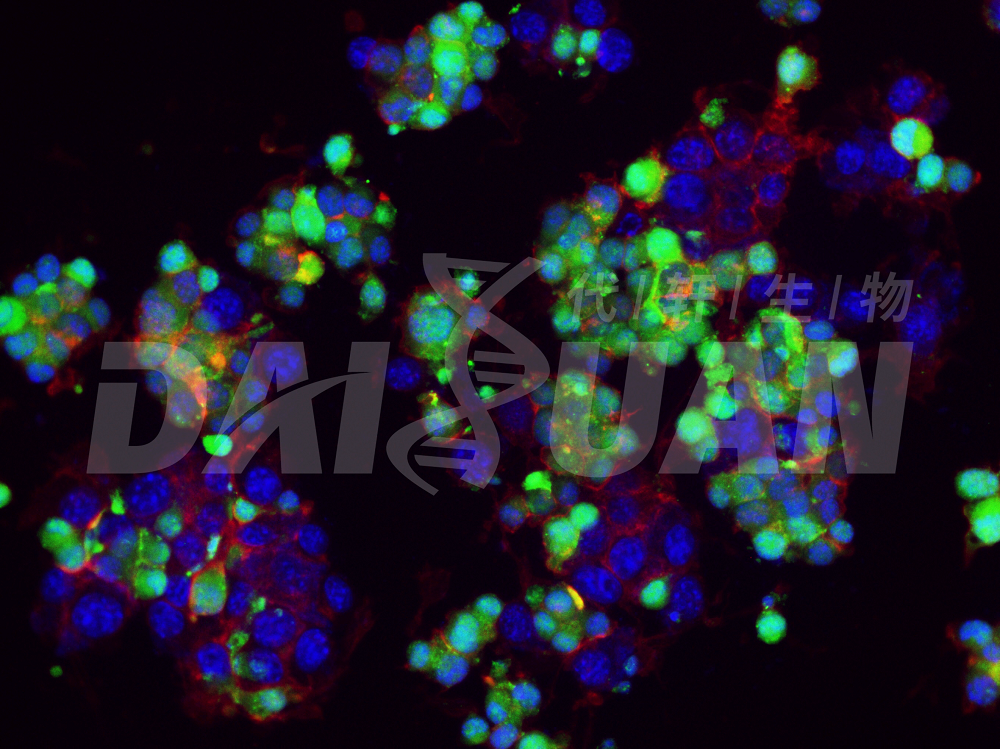
荧光染色图示(绿色是CFSE标记的凋亡细胞,红色是鬼笔环肽,蓝色是DAPI)
3. 注意事项
-
凋亡细胞纯度:避免坏死细胞(PI阳性)干扰。
-
时间控制:过长孵育可能导致二次坏死。
-
温度:需在37℃进行,低温(4℃)可设阴性对照。
NO.2
胞葬的研究手段与方法
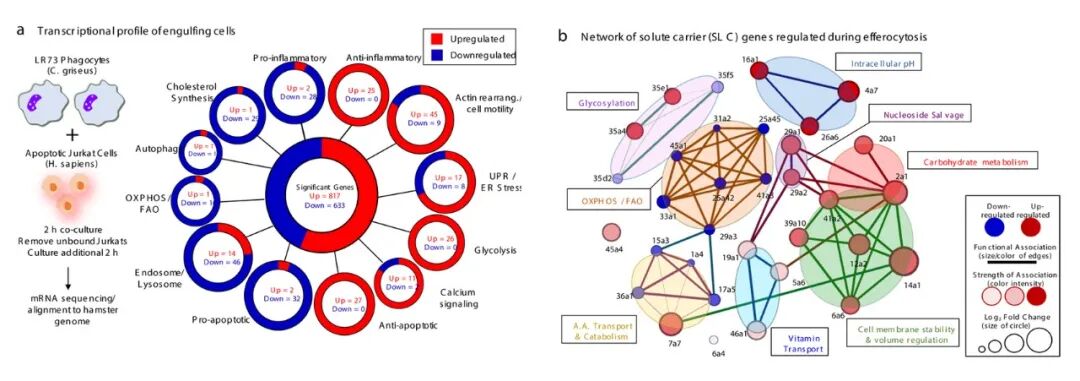
DOI: 10.1038/s41586-018-0735-5
胞葬(Efferocytosis)的研究手段与方法是一个多学科、多层次的体系,涵盖了从体外细胞模型到体内动物模型,以及从形态观察到分子机制探测的多种技术。
以下是目前该领域主流的研究手段与方法:
体外胞葬功能评估
-
荧光标记与流式细胞术
使用pHrodo Red、CFSE、PKH26等荧光染料标记凋亡细胞,其中pHrodo在酸性吞噬体内荧光增强,可特异性区分表面附着与真正吞噬。通过流式细胞术定量分析吞噬细胞中荧光阳性比例,准确评估胞葬效率。
-
活细胞成像与共聚焦显微镜
采用CFSE(绿色)标记凋亡细胞,DiI(红色)标记吞噬细胞,通过实时成像观察吞噬过程。共聚焦显微镜可提供三维结构信息,分析吞噬体形成和溶酶体融合动态。
-
体外吞噬实验体系
通过紫外照射或staurosporine处理诱导细胞凋亡,与巨噬细胞共培养。可加入anti-MerTK抗体、PI3K抑制剂等干预条件,解析特定通路功能。
体内胞葬功能研究
-
动物模型研究
建立动脉粥样硬化、肿瘤等疾病模型,尾静脉注射荧光标记凋亡细胞,追踪体内清除动力学。组织切片免疫荧光染色分析F4/80+吞噬细胞与凋亡细胞共定位。
-
转基因报告系统
mCherry-eGFP双荧光系统:pH敏感eGFP在酸性环境中淬灭,mCherry保持稳定,可监测吞噬体酸化过程。
CharON果蝇模型:整合GFP凋亡报告子和pHlorina酸化传感器,实时监测体内胞葬全过程。
分子机制解析
-
基因编辑技术
利用siRNA、CRISPR-Cas9敲除关键基因(如Rac1、MerTK),评估对胞葬效率的影响。
-
多组学分析
通过单细胞RNA测序分析吞噬细胞转录组特征,Western Blot、qPCR检测MerTK、Gas6、IL-10等关键分子表达。
-
功能干预研究
抑制剂:UNC2250(MerTK抑制剂)、TIM4阻断抗体、NOAH(Arg1抑制剂)
激活剂:吡格列酮(PPARγ激动剂)、棕榈酰乙醇酰胺(PEA)
NO.3
疾病关联与治疗前景

胞葬作用示意图(图片来自 Circulation 杂志)
疾病关联
胞葬作用功能失调与多种重大疾病密切相关。
-
自身免疫性疾病
系统性红斑狼疮(SLE):是胞葬缺陷最经典的疾病模型。患者体内巨噬细胞清除凋亡细胞(尤其是凋亡的淋巴细胞)的能力下降,导致核抗原暴露,被免疫系统识别,进而产生大量自身抗体,引发全身性炎症。MerTK、MFG-E8等分子的功能缺失或基因多态性与SLE易感性相关。
-
动脉粥样硬化
动脉粥样硬化斑块内含有大量凋亡的泡沫细胞(脂质负载的巨噬细胞)。如果胞葬作用有效,斑块会趋于稳定;如果胞葬功能不足,则会发生“继发性坏死”,释放促炎内容和促凝物质,导致斑块不稳定、破裂,引发心肌梗死或脑卒中。
-
神经系统疾病
阿尔茨海默病(AD):大脑中Aβ斑块周围存在大量凋亡神经元和小胶质细胞(大脑的巨噬细胞)。小胶质细胞的胞葬功能受损,无法有效清除这些“垃圾”,加剧了神经炎症和神经元损失。
帕金森病(PD)、肌萎缩侧索硬化(ALS):同样存在胞葬功能失调,导致病变蛋白和凋亡细胞累积。
-
癌症
肿瘤发生:胞葬缺陷导致基因组不稳定的凋亡细胞未被及时清除,可能向坏死转化,释放促炎因子,创造有利于肿瘤发生的微环境。
免疫逃逸:肿瘤细胞通过高表达“别吃我”信号(如CD47)来逃逸巨噬细胞的吞噬。靶向CD47的抗体已成为极具潜力的抗癌疗法。
治疗抵抗:化疗和放疗会诱导大量肿瘤细胞凋亡,有效的胞葬可以清除它们并抑制炎症。然而,肿瘤相关巨噬细胞功能异常可能导致清除不全,反而促进治疗后的肿瘤复发。
-
感染与炎症
及时清除被病原体感染后凋亡的细胞,可以限制病原体扩散并抑制过度炎症。许多病毒(如巨细胞病毒)和细菌会编码蛋白来干扰胞葬过程,以利于自身生存。
治疗前景
调控胞葬作用已成为极具吸引力的治疗策略。
-
激动剂策略:对于胞葬功能不足的疾病(如动脉粥样硬化、SLE),开发小分子或生物制剂来增强MerTK、AXL等受体的活性,或提供外源性桥梁分子(如重组MFG-E8)。
-
抑制剂策略:对于癌症,使用抗CD47/抗SIRPα抗体来阻断“别吃我”信号,恢复巨噬细胞对肿瘤细胞的吞噬能力。
-
其他思路:通过调节胞葬后的免疫输出,将促炎的M1型巨噬细胞“重编程”为抗炎/修复的M2型。
胞葬作用远不止是“细胞清道夫”,它是一个连接细胞死亡、免疫调节和组织修复的核心生物学过程。对其机制的深入理解和在疾病中的应用探索,正为治疗自身免疫病、心血管疾病、神经退行性疾病和癌症开辟全新的道路。未来的研究将更侧重于在特定疾病微环境中精准调控胞葬作用,并开发出高效、特异的治疗药物。
BiotechDX
代轩生物丨胞葬相关服务

服务覆盖胞葬研究的主要环节:
体外胞葬功能分析服务
细胞培养与模型构建:我们可提供RAW264.7、THP-1等巨噬细胞系的标准化培养,亦可由客户提供的骨髓或外周血样本中分离并培养原代巨噬细胞。同时,我们具备成熟的诱导技术,可为您制备多种凋亡细胞模型(如Jurkat细胞、胸腺细胞等),以满足不同研究需求。
基因功能研究:
-
基因过表达:在吞噬细胞中过表达您感兴趣的目标基因。
胞葬效率定量检测:
-
流式细胞术方案:使用CFSE/CMFDA等染料标记凋亡细胞,与处理后的吞噬细胞共培养,通过流式细胞术精确量化吞噬效率。
交付成果:流式细胞图、统计图表、分析报告。
体外胞葬功能的定性与定量分析
共聚焦成像与定量:
实验设置:将经过基因操作(过表达/敲除)的吞噬细胞与pHrodo标记的凋亡细胞共培养。
图像采集:使用共聚焦显微镜进行多视野、多通道的Z-stack扫描。
图像分析:
定性分析:提供清晰、高质量的合并图像、单通道图像和三维重建图像,直观展示实验结果。
定量分析:通过图像分析软件(如ImageJ, Imaris等)统计:
-
胞葬发生率:含有pHrodo阳性信号的吞噬细胞占总吞噬细胞的百分比。
-
每个吞噬细胞的胞葬数量:每个吞噬细胞内吞的凋亡细胞平均数。
交付成果:高分辨率共聚焦图像、三维重建视频、定量分析数据图表。
分子机制探索服务
配体-受体相互作用验证:综合运用免疫共沉淀、Pull-down、ELISA等实验技术,明确验证受体与候选配体之间的直接相互作用,为信号通路研究提供关键证据。
信号通路研究:在胞葬过程中,通过Western Blot、磷酸化蛋白芯片等技术,检测下游信号通路(如Akt, ERK, Rac1)的激活情况。
转录组测序:对比胞葬发生前后,或基因敲除与对照组的巨噬细胞,通过RNA-Seq分析基因表达谱的差异,寻找下游关键基因。
交付成果:Western Blot图、相互作用验证数据、测序分析报告。
体内动物模型验证服务
基因修饰动物模型构建:定制或利用现有模型(如全身性或细胞特异性敲除鼠)。
疾病模型构建与评估:构建动脉粥样硬化(ApoE⁻/⁻)、肺纤维化、腹膜炎等疾病模型。
体内胞葬效率评估:通过尾静脉或腹腔注射荧光标记的凋亡细胞,一段时间后收取组织(肝、脾、病灶等),通过流式细胞术分析原位吞噬细胞对凋亡细胞的清除情况。
组织学与病理学分析:
-
石蜡/冰冻切片制作。
-
H&E、Masson染色:评估组织形态和纤维化。
-
免疫组织化学/免疫荧光:检测目标蛋白的表达定位、细胞浸润、凋亡细胞清除情况(如TUNEL与巨噬细胞标志物共染色)。
交付成果:动物表型数据、组织切片、染色图片及分析报告。
咨询定制技术方案,让实验难题秒变paper数据!


BIOTECHDX
电话丨021-58598129
官网丨www.biotechdx.com
邮箱丨marketing@biotechdx.com



