RAW264.7 巨噬细胞培养与极化诱导经验分享
RAW264.7 巨噬细胞源于 Abelson 鼠白血病病毒诱发的肿瘤,是永生化细胞系,具有巨噬细胞的典型特征,能高效表达多种细胞因子、炎症介质,在免疫调节、炎症反应、肿瘤研究等领域都是不可或缺的“主力军”。但它的“脾气”也不小,对培养环境极为敏感,温度、pH值、血清质量等稍有偏差,就可能“闹情绪”,罢工甚至死亡。所以,培养前一定要深入了解它的习性,才能投其所好,让它茁壮成长。

RAW264.7 形态以类圆形和不规则为主,一般1-2个核,极少数有3个核,胞浆伸展时胞体较大。镜下细胞为小珍珠似的圆形 / 椭圆形。
以下是针对 RAW264.7 巨噬细胞的培养全流程经验总结,涵盖从收货到冻存的常见难点与解决方案,助你高效掌握这一“难驯”的细胞系:
一、到货处理:冷静验收,避免翻车
干冰运输验收:
检查干冰是否耗尽,细胞是否浸没于干冰内。
若干冰较少且温度 > -80℃,优先复苏。
若仍冷冻,立即转移至液氮罐 / -80℃冰箱。
T25瓶启动培养:
观察瓶中细胞状态,确定是否需要传代换液和静置。
若细胞已长满,请及时传代。
⚠️ 关键注意:
弃用运输培养基,务必使用新配制的完全培养基培养。首次传代建议 1:2。
二、复苏:快速轻柔,拒绝损伤
预热 37℃ 水浴锅(勿过热)。
快速摇晃解冻冻存管(37℃水浴),酒精擦拭后移入超净台。
缓慢注入细胞悬液至预冷的完全培养基(中和DMSO)。
低速离心:1000rpm × 3min(避免高速损伤)。
弃上清,轻柔重悬于新鲜培养基。
接种至培养皿(含适量新鲜培养基),培养过夜。
⚠️ 避坑指南:
黑点:复苏后常见(多为死细胞碎片),换液可清除。
漂浮细胞:48小时内允许存在,静待贴壁(避免过度吹打)。
三、传代:无酶吹打,控制密度
1. 准备: 预热完全培养基、无菌PBS / 新鲜培养基(吹打用)、培养皿(≥6cm)。
2. 移除旧液: 吸弃旧培养基(勿触及细胞层)。
3. 润洗:加 3mL PBS / 培养基,轻晃润洗瓶底,吸弃(去碎片)。
4. 无酶吹打(核心):
加 2-3mL PBS / 培养基覆盖瓶底。
用 5mL移液管 30°角螺旋吹打(外周→中心),重点照顾“小菌落”边缘。
终点:细胞层呈纱状飘起(约10-15次)。
5. 终止与收集:
加等体积含血清培养基(中和刺激)。
移入离心管,不离心(避免二次损伤)。
6. 接种扩培:
按 1:3(推荐比例)稀释细胞悬液(推荐密度:2-3×10⁵ / mL)。
直接接种至含预铺培养基的培养皿。
⚠️ 状态监控:
分化预警:伪足延长、体积增大、贴壁变牢 → 降低密度或缩短周期。
💡 密度控制关键区间:
<30%:生长停滞(因子不足)→ 补加条件培养基。
30-70%:理想增殖(圆形,无伪足)。
>70%:叠层+伪足分化 → 触发炎症因子(如TNF-α)释放。
💡 形态学监测指南:
|
状态 |
形态特征 |
处理对策 |
|
健康 |
圆形,小菌落贴壁,无触角 |
维持当前传代节奏 |
|
预警 |
边缘细胞伸出短触角 |
24小时内必须传代! |
|
分化 |
伪足延长,贴壁牢固 |
1:6高比例传代,补充新鲜培养基 |
|
老化 |
细胞间隙增大,漂浮增多 |
丢弃,启用新批次细胞 |
四、冻存:程序降温,保障存活
- 基础:70% 完全培养基
- 保护剂:20% FBS(高血清减少冰晶损伤)
- 防冻剂:10% DMSO(提前预冷,避免放热)
操作要点:
取对数生长期细胞,消化后离心浓缩(密度建议 5×10⁶ / mL)。
逐滴加入冻存液,轻柔混匀。
分装至冻存管(每管1-1.5mL),标注信息。
程序降温:
4℃ 30min → -20℃ 2h → -80℃ 过夜 → 液氮长期保存
(直接放-80℃存活率骤降!)
RAW264.7——培养难点及解决方案
|
问题 |
原因分析 |
解决方案 |
|
贴壁不牢 / 大量漂浮 |
复苏损伤、消化过度、支原体污染、血清失效 |
静置培养48h;优化传代操作;检测支原体;测试新批次血清 |
|
增殖缓慢 |
血清质量差、密度过低、老化、FBS浓度不足 |
更换优质FBS;提高接种密度;及时传代;增加FBS至15% |
|
伪足增多(分化) |
传代过密、培养时间过长 |
保持≤90%密度传代;避免持续培养>3天 |
|
黑点污染 |
血清沉淀、细胞碎片 |
换液清除;低速离心去除;过滤培养基 |
|
复苏后不贴壁 |
DMSO毒性、复苏操作过慢 |
严格按流程稀释离心;解冻时间≤60秒 |
|
支原体感染 |
操作污染或交叉感染 |
定期检测;加Plasmocin™处理2周 |
RAW264.7 培养黄金法则
血清一致性:固定品牌&批次(如Gibco, HyClone),提前分装避免反复冻融。
温柔操作:吹打力度≤吸头1/3处,避免气泡产生。
环境稳定:保持37℃、5% CO₂(巨噬细胞对pH波动敏感)。
定期检测:每2月做支原体检测(PCR或染色法)。
RAW264.7 培养心得
RAW264.7 培养需要“既谨慎又果断”!
✔️ 谨慎:操作轻柔、环境洁净、试剂优质
✔️ 果断:及时传代、见污染即弃、冻存备份
以上分享了 RAW264.7 巨噬细胞培养的全方位经验。
此外,作为一种常用的巨噬细胞模型,RAW264.7 极化可模拟向 M1(促炎)或 M2(抗炎)表型分化,用于研究免疫应答、炎症疾病及药物作用机制。通过极化能明确细胞在不同微环境下的功能变化,如 M1 型分泌促炎因子(TNF-α、IL-6),M2 型参与组织修复,为疾病病理机制和治疗靶点筛选提供体外研究基础。

巨噬细胞极化模式与1型 / 2型反应原则一致。巨噬细胞能够在特定介质的影响下显示不同的功能表型,其中许多是拮抗性的。
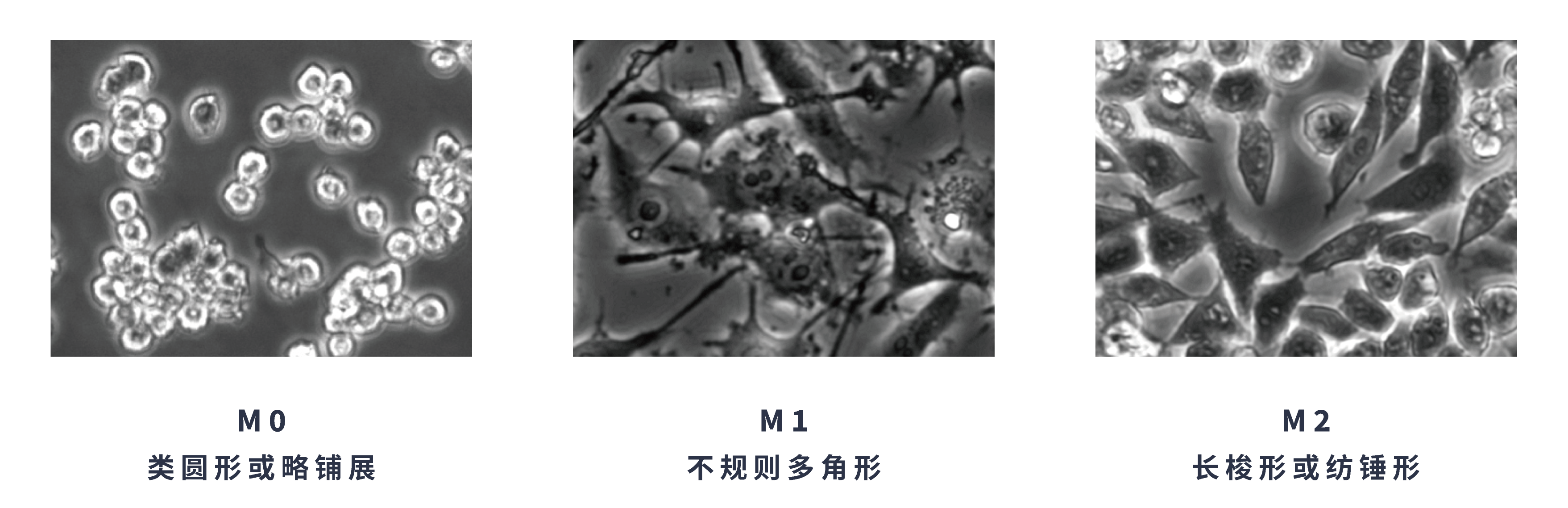
注:形态仅为辅助指标,细胞密度影响形态。
M1 型——经典活化,促炎型
✔️ 诱导剂
LPS(100 ng / mL)+ IFN-γ(20-50 ng / mL),刺激 24小时。
✔️ 特征性标志分子
|
类别 |
标志物 |
功能 / 意义 |
|
基因 (mRNA) |
iNOS (Nos2) |
一氧化氮合成酶,促炎反应核心 |
|
|
TNF-α (Tnf) |
核心促炎细胞因子 |
|
|
IL-6 (Il6) |
促进炎症和发热 |
|
|
IL-1β (Il1b) |
激活炎症通路 |
|
|
IL-12 (Il12b / p40) |
驱动Th1免疫应答 |
|
蛋白 |
iNOS |
催化产生 NO(关键效应分子) |
|
|
COX-2 |
促炎介质合成酶 |
|
分泌因子 |
NO |
M1核心代谢产物,杀伤病原体 |
|
|
TNF-α, IL-6, IL-12, IL-1β |
促炎细胞因子(ELISA检测) |
|
表面标志物 |
CD86 / CD80 |
共刺激分子,激活T细胞(流式) |
|
|
MHC-II(高表达) |
抗原提递能力增强 |
✔️ 鉴定重点:iNOS / NO + TNF-α / IL-6 组合是M1的黄金标准。
LPS (脂多糖) 使用规范与浓度准确性控制建议:
在使用LPS进行巨噬细胞M1极化诱导时,确保加入体系的实际LPS浓度精确达到目标浓度至关重要。实验未观察到预期效应(如促炎因子表达升高、M1表型标志物变化等),除了细胞状态、培养条件等因素外,LPS溶液配制、储存和操作不当导致的活性成分损失是一个需要高度警惕的技术性因素。
关键问题:LPS的非特异性吸附
LPS分子具有强疏水性,极易通过疏水相互作用非特异性吸附于多种实验室常用容器的表面,包括:
普通塑料材质 (如未经处理的聚丙烯EP管、细胞培养板 / 瓶)
某些类型的玻璃 (特别是硼硅酸盐玻璃)
Sigma LPS 说明书明确指出:
“浓度为1 mg / mL的LPS溶液在缓冲液或培养基中,于2-8°C下可稳定约一个月。冷冻状态(通常指 ≤ -20°C)下最多可保存2年。不建议反复冻融。溶液应储存在硅烷化处理的容器中,因为LPS可以与塑料和某些类型的玻璃(特别是浓度 < 0.1 mg / mL时)发生结合。只有当LPS浓度 > 1 mg / mL时,对小瓶侧壁的吸附才可忽略不计。”
吸附对低浓度LPS溶液的严重影响:
当使用普通容器(如标准EP管)储存或操作低浓度LPS工作液(例如100 µg / mL或更低)时,管壁吸附会导致溶液中实际游离的、具有生物活性的LPS浓度显著低于理论配制浓度。
这意味着加入细胞培养体系的有效刺激剂量远低于预期,可能导致刺激强度不足,无法有效诱导目标反应(如M1极化),造成假阴性结果。
推荐解决方案:标准化分装与使用流程
为最大限度地减少吸附损失,确保每次实验使用准确的LPS浓度,强烈建议采用以下经过优化的分装和使用策略:
1. 母液配制 (1 mg / mL):
使用无热原水或专用缓冲液(如组织培养级PBS)溶解LPS粉末,配制成 1 mg / mL (1000 µg / mL) 的储备母液。
配制和分装过程使用硅烷化处理的无热原玻璃瓶或管,或低吸附 / 无热原的聚丙烯材质容器(专为蛋白质 / 生物分子设计)。避免使用普通玻璃或未经处理的塑料容器。
2. 小体积分装:
立即将配制好的1 mg / mL母液分装至预冷的、硅烷化处理或低吸附的无热原微量离心管中。
推荐分装体积:10 µL / 管。此体积便于后续稀释,并确保单次解冻后基本用完,避免反复冻融。
清晰标记分装管(LPS浓度、批号、日期)。
3. 储存:
将分装管迅速置于 ≤ -20°C (推荐) 或 -80°C 条件下冷冻保存。
保存期限: 理论上冷冻可保存2年,强烈建议在6个月内使用完毕以保证最佳活性。
4. 工作液配制(现配现用):
每次实验前,取出所需数量的单支分装管 (10 µL, 1 mg / mL)。
在冰上或室温下解冻。
使用无热原水、缓冲液或完全培养基,将解冻的母液稀释至所需的中间工作浓度(推荐为 10 µg / mL)。例如,将10 µL母液加入990 µL稀释液,得到10 µg / mL工作液。
关键:此稀释步骤必须使用低吸附容器(硅烷化玻璃或低吸附塑料),且稀释后的工作液应尽快使用。
避免: 预先大量稀释储存低浓度工作液;反复冻融同一支分装管。
5. 使用:
根据实验设计,从现配的中间工作液(如10 µg / mL)中吸取所需体积,立即加入细胞培养体系中,达到最终刺激浓度(如100 ng / mL)。
计算最终浓度时,需考虑培养基体积。
核心原则总结:
高浓度储存 (>1 mg / mL): 显著降低管壁吸附比例。
小体积单次使用分装: 避免反复冻融导致的活性降解和多次操作带来的吸附累积。
硅烷化 / 低吸附容器: 用于所有接触LPS溶液的步骤(溶解、储存、稀释),特别是在处理低浓度溶液时。
工作液现配现用: 稀释后的低浓度工作液稳定性差且易吸附,必须在使用前临时配制。
Ps. 为确保实验可重复性和结果可靠性,LPS建议使用国际品牌(Sigma等)。
M2 型——替代活化,抗炎 / 修复型
✔️ 诱导剂
IL-4(20 ng / mL)+ IL-13(20 ng / mL),刺激 48-72小时。
✔️ 特征性标志分子
|
类别 |
标志物 |
功能 / 意义 |
|
基因 (mRNA) |
Arg1(精氨酸酶1) |
替代 iNOS,促进组织修复 |
|
|
Ym1 (Chil3) / Ym2 |
几丁质酶样蛋白,修复表型 |
|
|
Fizz1 (Retnla) |
抵抗素样分子,抑制炎症 |
|
|
Mrc1 (CD206) |
甘露糖受体基因 |
|
|
IL-10 (Il10) |
核心抗炎细胞因子 |
|
蛋白 |
Arg1 |
降解精氨酸,抑制 NO 产生,促进修复 |
|
|
CD206(甘露糖受体) |
M2最常用表面标记(流式 / IF) |
|
|
Ym1 / 2, Fizz1 |
修复相关蛋白(WB / IHC) |
|
分泌因子 |
IL-10 |
抑制炎症,促进免疫耐受(ELISA 检测) |
|
|
TGF-β |
组织纤维化和修复 |
|
表面标志物 |
CD206 |
高特异性 M2 标记(流式首选) |
|
|
CD163(可溶性) |
血红蛋白清除受体(部分 M2 亚型) |
✔️ 鉴定重点:Arg1 + CD206 + IL-10 三指标联合可以可靠确认M2极化。
标志物检测方法推荐
|
标志物 |
推荐检测方法 |
|
iNOS / Arg1 |
WB / qPCR / 免疫荧光 |
|
CD206 |
流式细胞术 / IF |
|
细胞因子 |
ELISA(上清)或多因子检测平台 |
⚠️ 避坑指南:
RAW 264.7的 Arg1蛋白需48-72小时充分表达,短时刺激可能阴性。
CD206 在M2中特异性高,但某些肿瘤相关巨噬细胞(TAMs)也表达,需结合功能分子(如IL-10)确认。
代轩生物提供 “极化诱导→功能验证”全流程服务,精准解析巨噬细胞M1 / M2表型。
服务覆盖六大核心模块:极化诱导、流式、免疫荧光、ELISA、Western、PCR。
|
服务模块 |
技术亮点 |
|
极化诱导 |
国际标准诱导体系(LPS / IFN-γ 诱导M1;IL-4 / IL-13 诱导 M2 ),严格质控细胞状态。 |
|
流式检测 |
CD86 / CD206双标鉴定M1 / M2,支持多色Panel 定制。 |
|
免疫荧光 |
iNOS / Arg1空间定位成像,提供高分辨细胞形态+分子共定位分析。 |
|
ELISA |
TNF-α / IL-10等细胞因子定量,高灵敏度检测(pg 级)。 |
|
Western Blot |
iNOS、Arg1、CD206等关键靶点蛋白表达验证。 |
|
qPCR |
20+极化基因检测(Tnf, Il6, iNos, Arg1, Ym1 等),提供 ΔΔCt 分析报告。 |
✔️ 代轩优势:
-
采用低代次RAW264.7(P3-P5),响应一致性(CV<5%)
-
提供极化预实验免费试做
✔️ 严格的质控体系
|
环节 |
代轩标准 |
行业平均 |
|
细胞活力 |
复苏存活率 ≥95%(台盼蓝) |
85-90% |
|
流式分辨率 |
阳性群CV值 <5% |
8-12% |
|
Western条带 |
无降解条带(蛋白酶抑制剂护航) |
常见降解 |
|
ELISA灵敏度 |
TNF-α检测限 1.5 pg / mL |
5-10 pg / mL |
若你在实验中还有其他困惑,或想了解更多进阶技巧,欢迎咨询获取~



