动物模型构建丨盲肠结扎穿刺法(CLP)诱导脓毒症模型
脓毒症是机体在严重感染等因素作用下,神经、免疫、内分泌及凝血等系统功能受损,引发免疫细胞过度活化,导致大量促炎细胞因子释放,触发全身炎症瀑布反应并持续加重的危重综合征。尽管脓毒症研究已达分子水平且临床治疗手段不断完善,脓毒症及其导致的休克、多器官功能障碍综合征(MODS)乃至多器官衰竭(MOF),仍是外科危重患者死亡的主要原因。盲肠结扎穿刺法(Cecum Ligation and Puncture, CLP)是构建脓毒症动物模型的经典方法,为相关临床研究奠定了重要的模型基础。
CLP脓毒症动物模型丨实验步骤
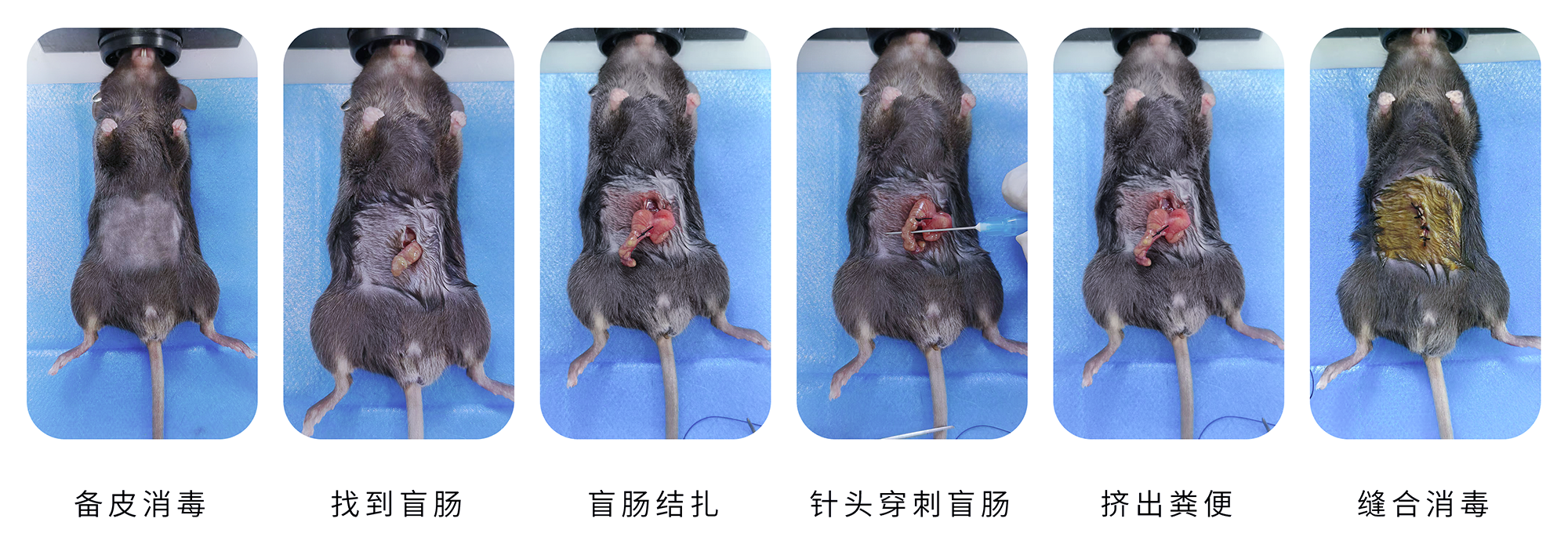
动物准备
选用体重21-25g的BALB/c或C57BL/6小鼠,或体重约220g的SD大鼠,性别不限。适应性饲养3-5天,实验前禁食12小时。
麻醉与备皮
动物麻醉后,仰卧位固定于手术板。腹部手术区域剃毛并常规消毒。
手术操作(无菌条件)
于腹中线作约2cm切口进腹。
定位回盲瓣,在距其远端约1/3盲肠处分离系膜(避免损伤主要血管)。
用3-0丝线结扎该处盲肠。
用18号注射针头贯穿穿刺结扎段盲肠1-2次,挤出少量肠内粪便,尽量避免损伤血管。
关腹与复苏
用4-0丝线间断缝合腹膜及皮肤。
立即皮下注射生理盐水(50ml/kg体重)进行液体复苏抗休克。
注意事项
动物选择:体重需严格符合要求(小鼠21-25g,大鼠200-220g),过轻或过重均影响模型稳定性。
无菌操作:手术环境、器械及操作过程必须严格无菌,避免外源性感染干扰。
术后护理:术后及时保温与充分补液对降低早期死亡率至关重要。
模型特征
造模后动物逐渐出现竖毛、腹泻、脓尿等症状,表现为饮水、进食及自主活动减少,昼夜活动节律紊乱。
CLP模型能有效模拟临床(尤其是继发于胃肠穿孔的)脓毒症病理过程,并良好反映脓毒症发展中免疫应答与血流动力学的动态变化。
CLP脓毒症动物模型丨Q&A常见问题解答
Q:造模后动物死亡率过高?
需关注以下关键点:
结扎位置:结扎点靠近盲肠底部(如结扎75%盲肠)会构建为重度致死性模型(致死率近100%)。标准模型通常结扎1/2至2/3盲肠(文中指1/3处结扎)。
麻醉方式:优先选用异氟烷吸入麻醉。戊巴比妥钠腹腔注射麻醉本身致死率较高。
液体复苏:术后必须立即补液(生理盐水,50ml/kg),并于3小时、6小时(即共两次)追加补液。
保温:术后维持动物体温,防止低体温休克致死。
饲养环境:术后动物置于清洁、尽量无菌的环境,预防继发感染。
Q:死亡率过低,甚至无动物死亡?
A: 此情况高度提示模型构建可能失败。首要检查点:穿孔操作是否确实将盲肠内容物(粪便)有效挤入腹腔? 这是诱发腹膜炎及后续脓毒症反应的关键步骤。
Q:死亡率过低,甚至无动物死亡?
此情况高度提示模型构建可能失败。
首要检查点:穿孔操作是否确实将盲肠内容物(粪便)有效挤入腹腔?这是诱发腹膜炎及后续脓毒症反应的关键步骤。
代轩生物丨动物模型构建服务 ▸ 百种成熟模型 ▸ 全流程质控 ▸ 数据可溯可靠
核心服务矩阵
|
服务模块 |
覆盖能力 |
技术亮点 |
|---|---|---|
|
动物模型构建
|
✔ 覆盖 神经、心血管、代谢、肿瘤、免疫 等8大系统 ✔ 120+ 疾病模型 成熟建模(如HIRI、卒中、糖尿病、帕金森) |
移植瘤PDX/CDX、手术精细化造模 |
|
生理功能检测
|
✔ 心功能超声(超声心动图) ✔ 无创血压监测 ✔ 神经行为学(水迷宫、旷场等) ✔ 运动功能(转棒、步态分析) |
小动物活体成像同步支持 |
|
精准指标分析
|
✔ 全自动生化检测(ALT/AST/Cr/BUN等) ✔ 血常规+凝血功能 ✔ 组织病理+免疫组化 ✔ ELISA/流式细胞术 |
支持多时间点动态监测 |
|
全流程支撑
|
动物饲养→模型构建→表型验证→数据分析→报告交付 |
实验-检测-解读一体化 |



