细胞周期检测
细胞增殖是一个受精密调控的过程,其核心是细胞周期——细胞从一次分裂结束到下一次分裂完成所经历的完整循环。该周期被划分为四个主要阶段:G0/G1期(细胞生长与准备)、S期(DNA合成)、G2期(分裂前检查与准备)和M期(有丝分裂)。这些阶段的进程与细胞内DNA含量的规律性变化紧密相关:细胞在G0/G1期拥有二倍体(2N) 的DNA含量;进入S期后,DNA开始复制,其含量从2N动态增加至4N;最终在G2/M期达到四倍体(4N) 的DNA含量,直至细胞分裂完成,子代细胞恢复2N含量。
流式细胞术正是利用这一关键的DNA含量变化特征来定量分析细胞周期分布的核心技术。其原理在于使用能特异性嵌入DNA双链的荧光染料(如碘化丙啶PI或DAPI),这些染料与DNA的结合量严格与DNA含量成正比,因此其发出的荧光强度直接反映了细胞内DNA的多少。流式细胞仪通过高速检测大量单个细胞的DNA荧光信号,生成反映群体DNA含量分布的直方图,进而通过数学模型拟合,精确统计出处于G0/G1期、S期和G2/M期细胞的相对比例,为研究细胞增殖状态、药物作用机制以及细胞周期调控等提供关键数据。
常用DNA染料 ▼

实验流程 ▼
- 细胞准备:获取状态良好、活性高的单细胞悬液。
- 处理:根据实验设计进行药物处理、刺激等。
- 收集:胰酶消化(贴壁细胞)或直接收集(悬浮细胞)。
关键点:轻柔操作,避免产生过多细胞碎片。
- 洗涤:用 PBS 或其他缓冲液洗涤细胞 1-2 次,去除培养基和血清干扰。
- (可选) 固定:如需使用 PI 或 DAPI,通常用预冷的 70% 乙醇固定(-20°C 保存数小时至数周)。
关键点:逐滴加入乙醇并持续轻柔涡旋混匀,防止细胞聚集成团。
- RNase 处理 (PI/DAPI 必需):固定后或染色前,用含 RNase A 的缓冲液孵育(通常 37°C, 15-30 分钟),彻底降解 RNA。
- 染色:加入含 DNA 染料的溶液(如 PI + RNAse 溶液)。避光孵育(通常室温或 37°C, 15-30 分钟)。
关键点:Hoechst 或 Vybrant 染料用于活细胞时,需优化浓度和时间(通常在 37°C 孵育)。
- 过滤:上机前必须使用细胞滤网(如 40 μm 尼龙网)过滤样品! 这是获得单细胞数据的关键。
- 上机检测:使用流式细胞仪采集数据。
实验结果示例 ▼
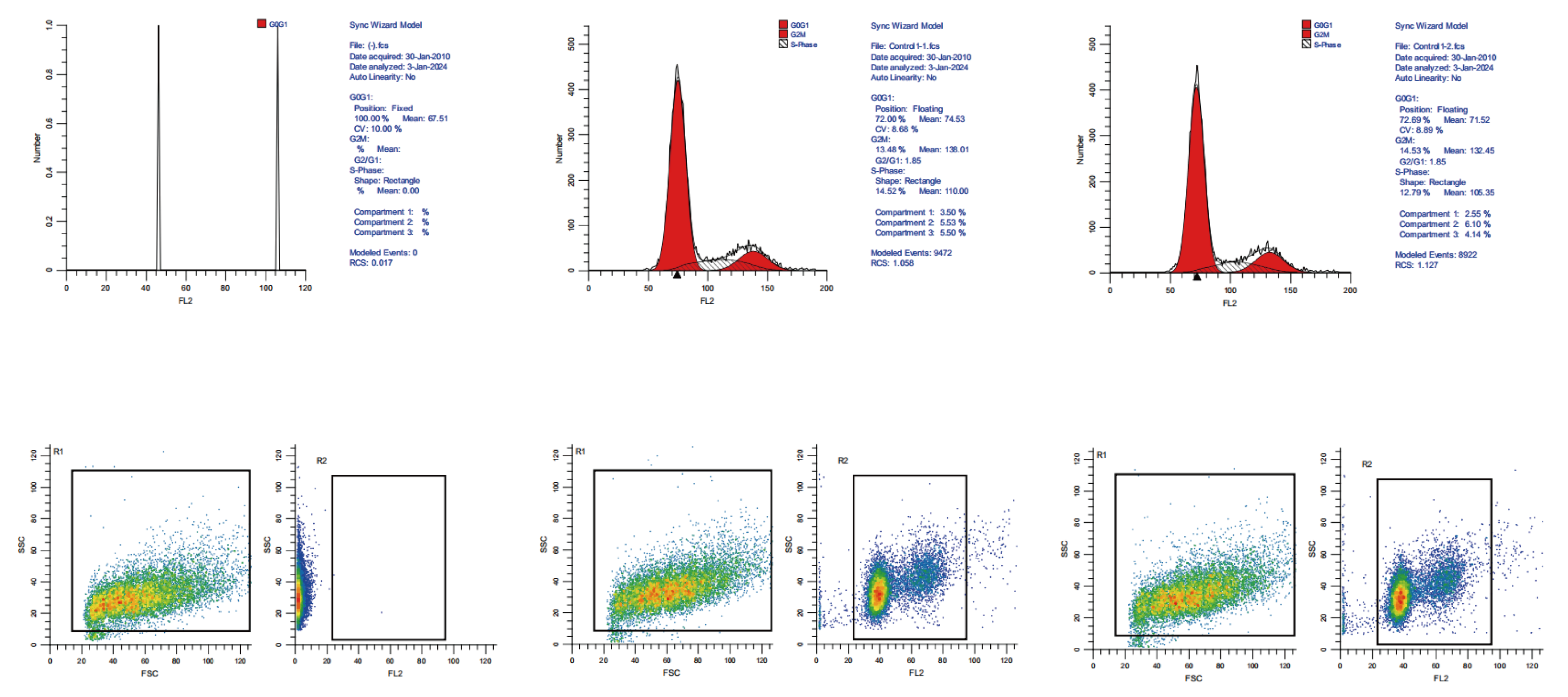
关键注意事项与问题解决 ▼
细胞数量不足
▂▂
(Events 太少)
原因:洗涤步骤离心损失;重悬过于剧烈损伤细胞;起始细胞数不足。
解决方案:
起始细胞数:进行细胞计数,确保最终染色后每管有至少 2 x 106 个细胞。
洗涤技巧:
-
离心后,用 200 μL 精细吸头 (黄色枪头) 小心吸弃上清。
-
不要吸得太干净!保留约 10-20 μL 液体在管底,避免吸走细胞团块。
-
轻柔重悬细胞沉淀,避免剧烈吹打产生气泡和碎片。
离心参数:使用合适的离心力(通常 300-400g)和时间(5-10分钟),避免过度离心导致细胞压紧难以重悬或损伤。
细胞聚集/粘连体
▂▂
(Doublets/Aggregates)
原因:PI 粘附性强;固定时乙醇加入过快导致蛋白变性聚集;样品本身有聚集。
解决方案:
固定关键:将预冷乙醇逐滴加入持续涡旋的细胞悬液中(或反过来将细胞悬液逐滴加入乙醇中)。
过滤:上机前必须过滤!
数据分析:必须去除粘连体!使用 FSC-A/FSC-H 或 PI 的 FL2-A/FL2-W (或对应染料的 Area/Width) 参数设门排除粘连体。粘连体会被误认为是 G2/M 期甚至多倍体细胞,导致结果严重偏差。
缓冲液:染色和上样缓冲液中可加入少量 BSA (0.1-1%) 或 EDTA (0.5-1 mM) 有助于减少非特异性聚集。
上样速度:使用较低的样品上样流速,减少流体压力导致的聚集。
峰形不佳
▂▂
(CV 值过高)
原因:染色不均;仪器状态不佳;细胞碎片多;上样速度过快。
解决方案:
染色优化:确保 RNase 充分消化 (PI/DAPI);保证染料浓度和孵育时间合适且一致;避光。
样品质量:减少细胞碎片(轻柔操作,必要时用 PBS 洗涤去除死细胞/碎片)。
仪器校准:定期用标准微球校准仪器,确保光路和液流稳定,CV 值符合要求。
上样速度:采用低速上样,使细胞逐个稳定通过检测点。
数据分析:确保在分析 DNA 含量直方图时,排除碎片和粘连体后,G0/G1 主峰尖锐(CV 值通常应 <8% 为佳,<10% 可接受)。
染料与染色特异性
▂▂
PI/DAPI + RNAse:绝对必须!忘记 RNase 会导致荧光信号异常增高(RNA+DNA),无法得到正确周期分布。
活细胞染料(Hoechst, Vybrant):注意细胞毒性,浓度过高或孵育时间过长会影响细胞活力和周期进程。需严格优化条件。活细胞分析避免了固定可能带来的影响。
提高 S 期分辨率
▂▂
双标法:结合使用 BrdU/EdU(标记新合成 DNA)和 DNA 染料(如 PI 或 Vybrant)。
BrdU/EdU 阳性细胞即为 S 期细胞,结合 DNA 含量分析可以更精确地区分早期 S、中期 S、晚期 S 期细胞。
数据分析要点
▂▂
线性 vs 对数坐标:DNA 含量直方图必须使用线性坐标轴 (LIN) 显示荧光强度。
脉冲信号:采集数据时,必须勾选并记录荧光信号的面积 (A) 和宽度 (W)(以及高度 H),这是进行粘连体去除 (Doublet Discrimination) 的基础。
设门策略:
-
FSC/SSC 或活染料 (如 DAPI 通道的活/死区分) 去除碎片和死细胞。
-
FSC-A/FSC-H 或 FL2-A/FL2-W (或对应染料 A/W) 去除粘连体。
-
在剩下的单细胞群体上分析 DNA 含量直方图。
拟合模型:使用专业软件(如 FlowJo, ModFit LT, FCS Express 等)的细胞周期拟合模块进行定量分析。不同模型(如 Dean-Jett-Fox, Watson Pragmatic)适用于不同情况,需根据峰形和数据质量选择。
其他注意事项
▂▂
对照:设置未处理或正常生长的细胞作为对照,用于设定门和分析参数。
重复:生物学重复和技术重复对于结果的可靠性至关重要。
安全:PI 是诱变剂,DAPI/Hoechst 也是核酸染料,操作时需戴手套,在指定区域操作,废液按有害化学废液处理。乙醇易燃,注意防火。
仪器配置:确保流式细胞仪的激光器和滤光片配置能激发和检测所选染料(如 PI 常用 488nm 激发,用 610/20nm 或 575/26nm 滤片收集;DAPI/Hoechst 需要紫外或近紫外激光激发)。
总结 ▼
流式细胞周期分析是一个相对成熟但细节决定成败的技术。
成功的关键在于
高质量的样品制备:单细胞悬液、足够细胞数、轻柔操作减少碎片和损失。
精确的染色步骤:RNase 消化、染料浓度、孵育条件、避免聚集。
严谨的上机操作:低速上样、必须过滤、仪器状态良好。
正确的数据分析:去除碎片和粘连体、使用线性坐标、脉冲信号去粘连、专业软件拟合。






